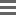【天天热闻】为了测定黄铜矿中铁铜的含量在科研人员_为了测定黄铜
 (相关资料图)
(相关资料图)
1、(1)由图表数据可以看出:根据第2份反应生成气体的质量与稀硫酸的质量成正比,则以此类推若120g稀硫酸全部反应会生成1.2g气体,但实际生成1.0g气体。
2、故第3份稀硫酸有剩余;则第4份稀硫酸也肯定剩余;故稀硫酸有剩余的是第3、4份.故答案为:第3、4份.(2)由表中数据分析可知:40g稀硫酸反应会产生0.4g气体,80g稀硫酸反应会生成0.8g气体,则要产生1.0g气体需要稀硫酸的质量为100g;而由表中数据分析可知。
3、第三次反应是合金中的锌反应完了;即第三份实验50g固体全部反应,而且反应掉稀硫酸100g;则黄铜屑与稀硫酸恰好完全反应时的质量比50g:100g=1:2;故答案为:1:2.(3)设合金中含锌的质量为 x,Zn+H2SO4═ZnSO4+H2↑65 2x 1.0g65x=21.0g解得:x=32.5g则黄铜样品中铜的质量分数50g?32.5g50g×100%=35.0%答:黄铜中铜的质量分数35.0%.。
本文到此分享完毕,希望对大家有所帮助。
X 关闭
推荐
-

【天天热闻】为了测定黄铜矿中铁铜的含量在科研人员_为了测定黄铜
发布时间:2023-04-07
-

中国自主研制的直升机“吉祥鸟”AC332完成全状态首次飞行|世界消息
发布时间:2023-04-07
-

云顶之弈S8.5三黑客妖姬阵容推荐 三黑妖姬装备阵容羁绊搭配攻略[多图]:快播报
发布时间:2023-04-07
-

2023郑开马拉松亲子马拉松起跑点在哪里?附路线图
发布时间:2023-04-07
-

每日观点:仟源医药:公司戒烟药酒石酸伐尼克兰片3月份已经生产
发布时间:2023-04-07
-

老人地铁求座被自称孕妇女子怒怼,网友:让座是美德,不是义务 世界热闻
发布时间:2023-04-07
-

世界热议:《祥瑞中国》主题展开幕 24位艺术家画“神兽”
发布时间:2023-04-07
-

潮声丨从马克龙访华,看欧洲的危与机|每日信息
发布时间:2023-04-07
-

长春4月6日24时供暖正式结束!这5件事情一定要注意!
发布时间:2023-04-07
-

自己的住宅楼可以办营业执照吗
发布时间:2023-04-07
Copyright 2015-2022 世界经济网版权所有 备案号: 琼ICP备2022009675号-1 联系邮箱:435 227 67@qq.com